Compostos iônicos são aqueles formados por íons de cargas opostas através de interação eletrostática, para uma substância ser considerada iônica, deve possuir pelo menos uma ligação iônica na sua estrutura. Nestes compostos o elemento metálico geralmente é um íon de carga positiva (cátion), e o elemento não metálico um íon de carga negativa (ânion).
Os íons que formam um composto iônico podem ser simples átomos, como ocorre no sal de cozinha (Na+ Cl‒) ou grupos mais complexos como ocorre no nitrato de potássio (K+ NO3‒). Quando dois íons se aproximam, uma atração eletrostática de carácter forte começa a aproximá-los.
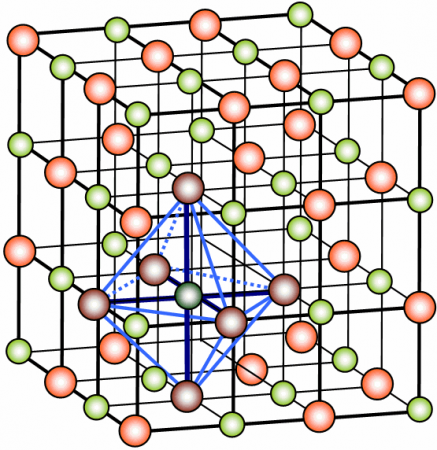
Se considerarmos que em um composto há milhares de moléculas, haverá milhares de íons para se atrair, em todas as direções, dando origem a retículos ou reticulados cristalinos, que são aglomerados de íons que se mantém juntos por atração eletrostática e possuem formas geométricas bem definidas. Quando esses aglomerados se unem, dão origem a uma rede ou estrutura cristalina que é composta de diversos unidades de aglomerados (celas unitárias), repetidas ao longo da cadeia.
Cela unitária é a menor representação de uma estrutura cristalina.
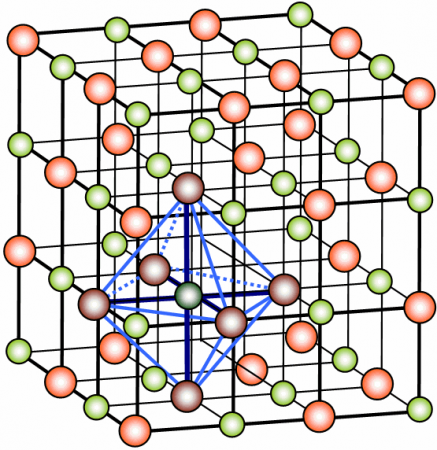
Retículo cristalino de NaCl. Ilustração: H. Hoffmeister / via Wikimedia Commons / CC-BY-SA 3.0
Podemos utilizar o exemplo do iodeto de césio (CsI) para ilustrar o processo:
O átomo de césio (Cs) possui distribuição eletrônica [Xe] 6s1, ou seja, possui 1 elétron em sua última camada e só ficará estável se perder este elétron. Já o iodo (I) possui distribuição eletrônica [Kr] 5s2 5p5, ou seja, possui 7 elétrons em sua última camada e só ficará estável se ganhar um elétron.
Ao aproximarmos esses átomos, o Cs doa seu elétron para o I, formando íons que se unem por atração eletrostática, a ligação iônica.
Cs+ + I‒ → CsI
Basicamente, a presença de retículos configura aos compostos iônicos as seguintes propriedades:
- São sólidos duros e quebradiços na temperatura ambiente.
- Possuem altos pontos de fusão e de ebulição pois é necessário uma grande energia para quebrar a atração eletrostática entre os íons do retículo. Como exemplo temos o cloreto de sódio (NaCl), em que a temperatura de fusão é 800 ºC e a de ebulição é 1413 ºC
- Conduzem corrente elétrica quando estão em solução aquosa (dissolvido em água), ou sob a forma fundida (líquida) pois os seus íons adquirem mobilidade para fechar o circuito e realizar a transferência de elétrons. Os cristais secos não conduzem eletricidade, a menos que apresentem defeitos na estrutura.
- Os compostos iônicos são polares devido a formação efetiva de cargas opostas em sua estrutura. Como a água também é polar, se torna uma bom solvente para compostos iônicos. No entanto, nem todos os compostos iônicos são solúveis em água facilmente, como é o caso do carbonato de cálcio (CaCO3), de estrôncio (SrCO3) e de bário (BaCO3), além do cloreto de prata (AgCl), que é praticamente insolúvel em água.
Bibliografia:
Atkins, P.W., Jones, L., Princípios de química: questionando a vida moderna e o meio ambiente 5ª ed., Porto Alegre: Ed. Bookman, 2012.
Usberco J., Salvador E., Química Geral, 12ª.ed., São Paulo: Saraiva, 2006.