- Quais são os dois compostos que pertencem a classe dos sais?
- H2SO4e NaBr
- KNO3e HCl
- Mg(MnO4)2e HCOOH
- K2CrO4e Al(ClO)3
RESOLUÇÃO
As classes principais dos compostos inorgânicos são quatro, óxidos, ácidos, bases e sais. A seguir consideremos as seguintes definições:
- Óxidossão compostos binários, isto é, constituídos por dois elementos sendo o Oxigénio o elemento mais electronegativo.
- Ácidossegundo Arrhenius são substâncias que em solução aquosa ionizam-se originando iões hidrogénio (H+);
- Basessegundo Arrhenius são substâncias que em solução aquosa dissociam-se originando iões hidroxilo (OH-);
- De acordo com a Teoria de Arrehnius,Sais são substâncias que em solução aquosa dissociam-se libertando pelo menos um catião diferente do H+ e um anião diferente de OH-.
Observemos:
H2SO4(aq) → 2H+(aq) + SO42-(aq) ⇒ é um ácido de Arrhenius.
NaBr(aq) → Na+(aq) + Br-(aq) ⇒ é um sal
K2CrO4(aq) → 2K+(aq) + CrO42-(aq) ⇒ é um sal
Al(ClO)3(aq) → Al3+(aq) + 3ClO-(aq) ⇒ é um sal
KNO3(aq) → K+(aq) + NO3-(aq) ⇒ é um sal
HCl(aq) → H+(aq) + Cl-(aq) ⇒ é um ácido de Arrhenius.
Mg(MnO4)2(aq) → Mg2+(aq) + 2MnO4-(aq) ⇒ é um sal
HCOOH(aq) → H+(aq) + HCOO-(aq) ⇒ é um ácido de Arrhenius.
Resposta: alternativa: D
- Qual destes óxidos não é básico?
- Na2O
- SO3
- Fe2O3
- Li2O
RESOLUÇÃO
Os óxidos basicamente classificam-se em óxidos metálicos ou óxidos básicos e óxidos ametálicos ou óxidos ácidos. Os óxidos básicos são constituídos por um elemento metálico e o oxigénio. Já os óxidos ácidos são constituídos por um elemento não metálico e o oxigénio.
Obs: nem todos os óxidos metálicos são básicos pois existem óxidos metálicos que manifestam um duplo carácter, isto é, têm propriedades básicas e ácidas que são designados de óxidos anfotéricos.
Portanto, um óxido não básico é um óxido ácido. E neste caso trata-se do SO3 que é formado pelo enxofre (um não metal) e o oxigénio.
Resposta: alternativa: B
- O que é que se forma na reacção entre um ácido e um óxido metálico?
- Ácido e base
- Base e água oxigenada
- Sal e água
- Sal e água oxigenada
RESOLUÇÃO
No geral os óxidos metálicos apresentam propriedades básicas, assim, um óxido metálico reage com um ácido formando um sal e água.
Ácido + óxido metálico → sal + água
Resposta: alternativa: C
- Qual é o nome de K2Cr2O7?
- Dicromato de Potássio
- Heptóxido de crómio de potássio (II)
- Óxido de crómio e potássio
- Percromato de potássio
RESOLUÇÃO
A substância dada K2Cr2O7, é um sal que e é constituída pelos iões K+ e Cr2O72-. Os iões K+ são designados de iões potássio e os iões Cr2O72- são chamados de iões dicromato. Assim, a nomenclatura dos sais obedece a seguinte regra:
Nome do anião + de + nome do catião
Portanto, o nome deste sal é: Dicromato + de + potássio = Dicromato de potássio
Resposta: alternativa: A
- Qual a aplicação do hidróxido de cálcio [Ca(OH)2]?
- Anestésico
- Fertilizantes
- Solvente orgânico
- Tratamento de água
RESOLUÇÃO
Uma das aplicações do hidróxido de cálcio é como agente floculante no tratamento da água.
Resposta: alternativa: D
- Qual é uma das característica de uma solução?
- Não se pode separar por sedimentação
- Ter vários solventes
- Só deve ter um soluto
- Ter fases diferentes
RESOLUÇÃO
Uma solução é uma mistura homogénea (apresenta uma única fase) de duas ou mais substâncias. Numa solução temos um único solvente no entanto podemos ter um ou mais solutos.
Ora vejamos algumas características de uma solução verdadeira:
| Características | Descrição |
| Natureza das partículas dispersas | átomos, iões ou moléculas |
| Tamanho médio das partículas | Menor que 1 nm |
| Visibilidade das partículas | As partículas não são vísiveis com nenhum aparelho (formam um sistema homogéneo) |
| Sedimentação das partículas | As partículas não se sedimentam |
| Separação por filtração | Não é possível por nenhum tipo de filtro |
Resposta: alternativa: A
- Qual é uma das classificações de uma solução quanto à proporção entre soluto e solvente?
- Gás/sólido
- Insaturada
- Líquido/Gás
- Sólida
RESOLUÇÃO
As soluções quano à proporção entre soluto solvente podem ser: soluções diluídas, concentradas, saturadas, insaturadas e supersaturadas.
Resposta: alternativa: B
- Qual é uma das aplicações de uma determinada solução?
- Produção de plástico
- Produção de água mineral
- Produção de explosivos
- Síntese de aditivos higroscópico
RESOLUÇÃO
Uma das soluções muito comum no nosso dia-a-dia é sem dúvidas a água mineral, que é constituída pela água que é o solvente e por sais minerais que são os solutos.
Obs: A formulação desta questão não foi muito bem-feita. Pode suscitar várias interpretações. Neste caso poderíamos questionar: qual é essa solução?
Por exemplo, o plástico pode ser obtido pelo processo de polimerização e uma das formas de polimerização é a polimerização em solução.
No geral, durante produção do plástico uma solução viscosa é colocada num molde apropriado para se obter o formato desejado.
Resposta: alternativas possíveis: B
- A composição aproximada por 300 ml de um sumo é de 60 g de vitamina C. Sabe-se que a capacidade da embalagem é de 500 ml.
- 90
- 100
- 160
- 220
RESOLUÇÃO
A informação “300 mL de um sumo é de 60 g” nos diz que em 300 mL de sumo temos 60 g de vitamina C. Ora se a capacidade da embalagem é de 500 mL isso significa que o volume do sumo que temos é exactamente de 500 mL.
Assim, se em 300 mL temos 60 g, quantos gramas teremos em 500 mL?
300 mL __________ 60 g
500 mL ___________ x
300 mL · x = 500 mL · 60 g
x = (500 mL · 60 g) / (300 mL)
x = 30000 / 300
x = 100 g
Resposta: alternativa: B
- Como se chamam as reacções em que a energia dos reagentes é superior à dos produtos a mesma temperatura?
- Endotérmicas
- Espontâneas
- Exotérmicas
- Explosivas
RESOLUÇÃO
Sabe-se que a variação de entalpia (∆H) de uma reacção é dada por: ∆H = ∑Hprodutos – ∑Hreagentes . Assim, se o somatório das entalpias dos reagentes (∑Hreagentes) é maior significa que a diferença
∑Hprodutos – ∑Hreagentes será um valor negativo. Logo, teremos:
∑Hprodutos < ∑Hreagentes ⇒ ∑Hprodutos – ∑Hreagentes < 0 ⇒ ∆H < 0.
Graficamente temos:
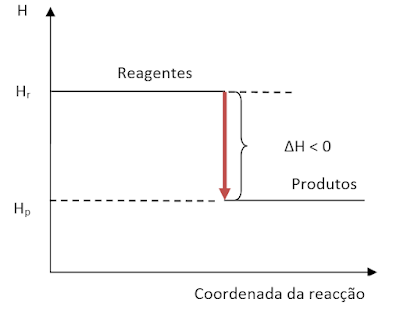
Portanto, a variação de entalpia (∆H) é um valor negativo e reacções químicas que têm ∆H < 0 são designadas de reacções exotérmicas.
Resposta: alternativa: C
Por: Miguel Pascoal

