DO EXAME DE ADMISSÃO DE QUÍMICA II – UEM 2023
- A aspirina tem uma densidade de 2,00 g/cm3. Qual é o volume (em centímetros cúbicos) de um comprimido de 100 mg?
A 200 cm3
B 100 cm3
C 50 cm3
D 0,02 cm3
E 0,05 cm3
RESOLUÇÃO
No Texto Unidades de Medidas vimos que a densidade (d) é a relação entre a massa e o volume de um material sendo dada pela fórmula:
Dados:
⦁ d = 2,00 g/cm3
⦁ m = 100 mg
Pedido:
⦁ V = ?
Veja que a densidade é dada em g/cm3 então temos que converter a massa dada em miligrama para grama. Lembrando que o prefixo “m” de mili tem como factor de multiplicação 10-3, assim, podemos substituir “m” nos 100 mg por 10-3:
100 mg ⇒ 100 ∙ 10-3 mg ⇒ 1 ∙ 102 ∙ 10-3 ⇒ 1 ∙ 102+(-3) ⇒ 1 ∙ 10-1 g ou 0, 1 g.
Usando a fórmula da densidade vamos calcular o volume.
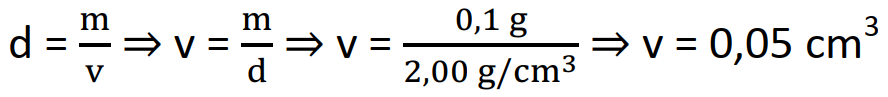
Resposta: alternativa: E
- A digitalina é um fármaco usado na reanimação de doentes cardíacos. Este fármaco deve ser administrado com muito cuidado pois, mesmo em pequenas overdoses, pode ser fatal. A administração deste fármaco é feita a base de mg/Kg de massa corporal. Assim uma criança e um adulto, apesar, de diferirem grandemente no peso, recebem a mesma dose por Kg do corpo.
Para uma dosagem de 20 µg/Kg de peso corporal, quantos mg de digitalina devem ser ministrados para um indivíduo de peso médio de 60 kg ?
A 1,2 mg
B 1200 mg
C 12 mg
D 0,003 mg
E 3 mg
RESOLUÇÃO
A informação “para uma dosagem de 20 µg/kg de peso corporal” quer dizer que por quilograma de peso corporal teremos vinto microgramas (20 µg) de digitalina. Ou seja:
1 kg _______________________ 20 µg
O prefixo micro, cujo símbolo é µ, o seu factor de multiplicação é 10-6. Portanto, podemos substituir µ por 10-6.
1 kg ____________________ 20 ∙ 10-6 g ou 1 kg ______________________ 2 ∙ 10-5 g
Note que: podemos escrever o 20 como sendo 2 ∙ 101, então teremos 2 ∙ 101 ∙ 10-6 = 2 ∙ (101+(-6)) = 2 ∙ 10-5 g.
Então a quantidade de digitalina que dever ministrada a um indivíduo de 60 kg (ou 6 ∙ 101 kg).
O número 12 ∙ 10-4 g pode ser escrito como 1,2 ∙ 10-3 g se a vírgula for deslocada uma casa decimal à esquerda. No entanto, o exercício pede a quantidade em miligramas (mg). Então podemos escrever:
1,2 ∙ 10-3 g ⇒ 1,2 mg, isto porque o prefixo mili (m) tem como factor de multiplicação 10-3.
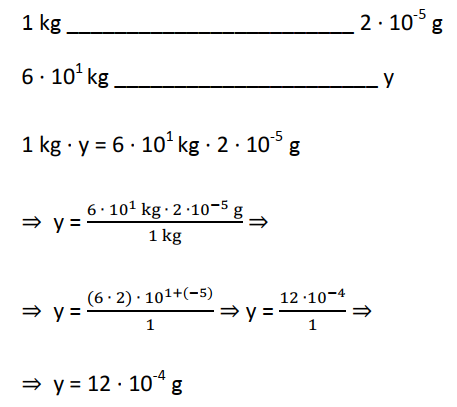
Resposta: alternativa: A
- Um dos principais ingredientes dos palitos de fósforo é o clorato de potássio (KClO3). Esta substância pode ser usada como fonte de oxigénio para muitas reacções de combustão e reage violentamente com o açúcar da cana (C12H22O11) para dar cloreto de potássio, dióxido de carbono e água, de acordo com a reacção:
KClO3 + C12H22O11 → KCl + CO2 + H2O
Os coeficientes estequiométricos para a reacção acertada são respectivamente:
A 1-1-1-12-11
B 1-1-1-12-12
C 1-1-1-12-2
D 8-2-8-24-22
E 8-1-8-12-11
RESOLUÇÃO
Os coeficientes estequiométricos são os números que aparecem antes de cada fórmula química numa equação química e durante o acerto de equações químicas só é permitido alterar estes números. Na realidade existem vários métodos de acerto de equações químicas mas o mais amplamente usado é o método de tentativas, contudo em qualquer um dos casos, durante o acerto de equações químicas deve-se garantir que o número de átomos de cada elemento químico nos dois lados da equação seja igual (Lei da Conservação da Massa).
Vamos acertar esta equação química pelo MÉTODO ALGÉBRICO:
- Para a equação química a seguir iremos atribuir letras quaisquer como coeficientes estequiométricos da equação:
a KClO3 + b C12H22O11 → c KCl + d CO2 + e H2O
- Para cada um dos elementos químicos iremos montar uma equação matemática, multiplicando o índice de cada elemento com a incógnita usada como coeficiente estequiométrico e igualaremos o número de átomos de cada elemento nos reagentes e produtos:
K: a = c
Cl: a = c
O: 3a + 11b = 2d + e
C: 12b = d
H: 22b = 2e
- Vamos atribuir um valor arbitrário aincógnita b, por exemplo, então b = 1. A seguir iremos substituir o valor de b na equação matemática montada para o elemento hidrogénio:
H: 22b = 2e ⇒ 22 · 1 = 2e ⇒ 22 = 2e ⇒ e = 22/2 ⇒ e = 11
Então já temos o valor de “b” e “e” (b = 1 & e = 11). Vamos substituir estes valores noutras equações de modo a acharmos os valores de outras incógnitas:
C: 12b = d ⇒ 12 · 1 = d ⇔ d = 12
O: 3a + 11b = 2d + e ⇒ 3a + 11 · 1 = 2 · 12 + 11 ⇒ 3a + 11 = 24 + 11 ⇒ 3a + 11 = 35
⇒ 3a = 35 – 11 ⇒ 3a = 24 ⇒ a = 24/3 ⇒ a = 8
K : a = c ⇒ 8 = c
Cl: a = c ⇒ 8 = c
Assim, os valores das incógnitas que achamos são: a = 8; b = 1; c = 8; d = 12; e = 11
Substituindo estes valores no lugar dos coeficientes estequiométricos da equação, temos:
8 KClO3 + 1 C12H22O11 → 8 KCl + 12 CO2 + 11 H2O ou 8 KClO3 + C12H22O11 → 8 KCl + 12 CO2 + 11 H2O
Conclusão: 8-1-8-12-11
Resposta: alternativa: E
- 44. Dadas as seguintes moléculas CaMg3Si4O12(asbesto); C6H8O6(vitamina C); sal da prússia ([(Fe4[Fe(CN)6]3]). As massas moleculares serão, respectivamente: (massa atómica em u.m.a: Ca – 40; Mg – 24; Si – 28; O – 16; C -12; H – 1; Fe – 56; N – 14).
A 416-176-436 u.m.a
B 416-176-716 u.m.a
C 416-176-860 u.m.a
D 416-176-1018 u.m.a
E 416-176-738 u.m.a
RESOLUÇÃO
A massa molecular, MM, é a massa de uma só molécula expressa em unidades de massa atómica (u).
Dado que uma molécula é constituída por vários átomos ligados entre si, então, a massa dessa molécula é a soma das massas atómicas de todos os átomos que a constituem.
CaMg3Si4O12 (asbesto)
Ca: 1 x 40 = 40
Mg: 3 x 24 = 72
Si: 4 x 28 = 112
O: 12 x 16 = 192
M(CaMg3Si4O12) = 40 + 72 + 112 + 192 = 416 u.
C6H8O6 (Vitamina C)
C: 6 x 12 = 72
H : 8 x 1 = 8
O : 6 x 16 = 96
M(C6H8O6) = 72 + 8 + 96 = 176 u.
(Fe4[Fe(CN)6]3 (sal da prússia)
Fe: 4 x 56 = 224
Fe: 3 x 56 = 168
C: 3 x 6 x 12 = 216
N: 6 x 3 x 14 = 252
M[(Fe4[Fe(CN)6]3] = 224 + 168 + 216 + 252 = 860 u.
Resposta: alternativa: C
- Considere a reacção de combustão do metano, CH4:
CH4(g) + 2O2(g) → CO2(g) +2H2O(g)
Se o metano é queimado a uma velocidade de 0,16 mol.dm-3, a que velocidade são formados os produtos, CO2 e H2O?
A d[CO2]/dt = 0,16 mol.dm-3; d[H2O]/dt = 0,08 mol.dm-3
B d[CO2]/dt = 0,16 mol.dm-3 ; d[H2O]/dt = 0,16 mol.dm-3
C d[CO2]/dt = 0,16 mol.dm-3 ; d[H2O]/dt = 0,32 mol.dm-3
D d[CO2]/dt = 0,08 mol.dm-3 ; d[H2O]/dt = 0,08 mol.dm-3
E d[CO2]/dt = 0,32 mol.dm-3 ; d[H2O]/dt = 0,08 mol.dm-3
RESOLUÇÃO
A velocidade de uma reacção pode ser definida como a variação da concentração dos reagentes ou produtos em um intervalo de tempo. A expressão para o seu cálculo é:
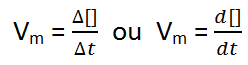
Portanto, d[] e dt indicam uma variação da concentração e do tempo respectivamente (rigorosamente falando trata-se de uma variação infinitesimal, ou seja, muito pequena).
Para uma reacção genérica: a A + b B → c C + d D, teremos:
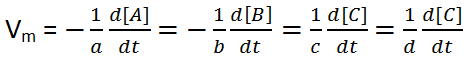
Assim, para a reacção dada pelo exercício teremos:
CH4(g) + 2O2(g) → CO2(g) +2H2O(g)
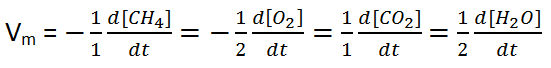
Assim teremos:

Resposta: alternativa: C
- O sulfureto de hidrogénio (H2S) é um poluente encontrado comummente em águas residuais industriais. Uma forma de remoção de H2S consiste em tratar a água com cloro (Cl2), de acordo com a reacção:
H2S(aq) + Cl2(aq) → S(s) + H+(aq) + Cl-(aq)
Se a reacção for de primeira ordem para cada um dos reagentes, a constante de velocidade para a reacção do consumo de H2S a 25oC for 4 x 10-2 M-1.s-1 e se num dado instante a concentração de H2S for 2 x 10-3 M e de Cl2 for 0,03 M, a velocidade da reacção será:
A 8 x 10-5 M.s-1
B 12 x 10-4 M.s-1
C 2,4 x 10-6 M.s-1
D 2,4 x 10-5 M.s-1
E 1,2 x 10-6 M.s-1
RESOLUÇÃO
O exercício diz que a ordem da reacção relação a cada um dos reagentes é um, portanto, teremos a seguinte expressão da lei de velocidade:
V = k∙[H2S]∙[Cl2]
Substituindo os valores na expressão teremos:
V = k∙[H2S]∙[Cl2]
V = (4 x 10-2 M-1.s-1) ∙ (2 x 10-3 M) ∙(0,0 3 M)
V = 2,4 x 10-6 M.s-1
Resposta: alternativa: C
- Considere a reacção:
N2O4(g) ⇌ 2NO2(g) ; ∆Ho = 60 KJ
Para que lado se deslocará o equilíbrio se: (a) adicionar N2O4; (b) adicionar NO2; (c) aumentar a pressão; (d) aumentar o volume; (e) diminuir a temperatura?
A (a) direita (direcção dos produtos); (b) esquerda; (c) direita; (d) esquerda; (e) esquerda.
B (a) direita; (b) esquerda; (c) esquerda; (d) esquerda; (e) direita.
C (a) direita; (b) esquerda; (c) esquerda; (d) direita; (e) esquerda.
D (a) esquerda; (b) esquerda; (c) esquerda; (d) direita; (e) esquerda.
E (a) esquerda; (b) esquerda; (c) esquerda; (d) direita; (e) direita.
RESOLUÇÃO
Para respondermos esta questão temos que conhecer os factores que afectam o estado de equilíbrio químico bem como o Princípio de Le Chatelier que diz “quando uma acção externa afecta um sistema em equilíbrio, este reage no sentido de minimizar ou anular o efeito dessa acção”.
Vamos analisar cada caso:
(a) adicionar N2O4
A adição de N2O4 ao sistema em equilíbrio faz com que a concentração de N2O4 (que é um reagente) aumente perturbando assim o estado de equilíbrio, deste modo para que um novo estado de equilíbrio seja alcançado é necessário o consumo das quantidades de N2O4 acrescidas. Como o N2O4 é um reagente, ao ser consumido produzirá mais NO2, assim, o equilíbrio desloca-se para a direita, ou seja, sentido de formação de NO2 (que é o produto).
(b) adicionar NO2
A adição de NO2 ao sistema em equilíbrio faz com que a concentração de NO2 (que é um produto) aumente perturbando assim o estado de equilíbrio, deste modo para que um novo estado de equilíbrio seja alcançado é necessário o consumo das quantidades de NO2 acrescidas. Como o NO2 é um produto, ao ser consumido produzirá mais N2O4, assim, o equilíbrio desloca-se para a esquerda, ou seja, sentido de formação de N2O4 (que é o reagente).
(c) aumento da pressão
A pressão e volume são grandezas inversamente proporcionais à temperatura constante (P x V = K). Consequentemente com o aumento da pressão ocorre a diminuição do volume e o equilíbrio desloca no sentido do menor volume, ou seja, a pressão aumenta e o volume diminui.
N2O4(g) ⇌ 2NO2(g)
1 mol ___ 2 mol
1 V _______ 2 V
Como se vê, o lado de menor volume é o lado dos reagentes (N2O4), portanto, com o aumento da pressão o equilíbrio desloca-se para a esquerda.
(d) aumento do volume
Já dissemos que a pressão e volume são grandezas inversamente proporcionais à temperatura constante P x V = K). Consequentemente com a diminuição da pressão ocorre o aumento do volume e o equilíbrio desloca no sentido do maior volume, ou seja, a pressão diminui e o volume aumenta.
N2O4(g) ⇌ 2NO2(g)
1 mol ___ 2 mol
1 V _______ 2 V
O lado de maior volume é o lado dos produtos (NO2), portanto, com o aumento do volume o equilíbrio desloca-se para a direita.
(e) diminuição da temperatura
A equação da reacção é: N2O4(g) ⇌ 2NO2(g) ; ∆Ho = 60 KJ
A variação de entalpia (∆H) desta reacção é positiva o que significa que a reacção directa é endotérmica e logicamente que a reacção inversa será exotérmica:
Reacção directa: N2O4(g) → 2NO2(g) ; ∆H = +60 KJ
Reacção inversa: 2NO2(g) → N2O4(g) ; ∆H = -60 KJ
Sabe-se que num sistema em equilíbrio o aumento da temperatura favorece a reacção endotérmica e a diminuição da temperatura favorece a reacção exotérmica e neste caso há diminuição da temperatura o que quer dizer que o equilíbrio desloca-se no sentido da reacção exotérmica, ou seja, o equilíbrio desloca-se para esquerda.
Conclusão: (a) direita; (b) esquerda; (c) esquerda; (d) direita; (e) esquerda.
Resposta: alternativa: C
- Dadas as seguintes reacções de equilíbrio:
(a) N2(g) + 3H2(g) ⇌ 2NH3(g); (b) 2NOBr(g) + Cl2(g) ⇌ 2NO(g) + 2BrCl(g); (c) PbCl2(s) ⇌ Pb2+(aq) + 2Cl-(aq); (d) CaCO3(s) ⇌ CaO(s) + CO2(g)
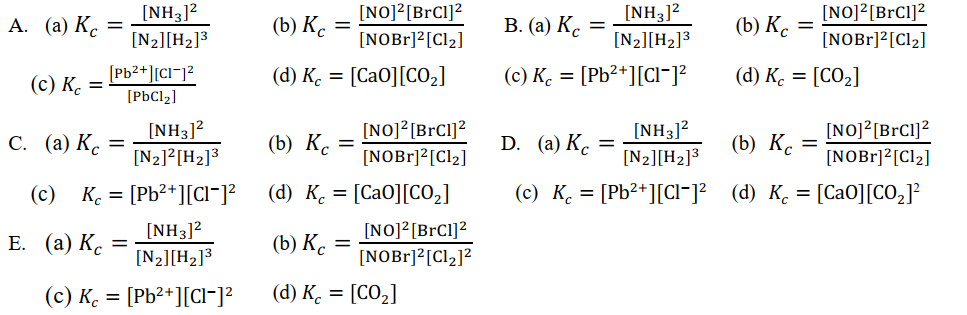
RESOLUÇÃO
No Texto Constantes de Equilíbrio foi dito que a constante de equilíbrio em função das concentrações (Kc) é o produto das concentrações dos produtos, dividido pelo produto das concentrações dos reagentes onde cada concentração está elevada ao seu coeficiente estequiométrico da equação química devidamente acertada.
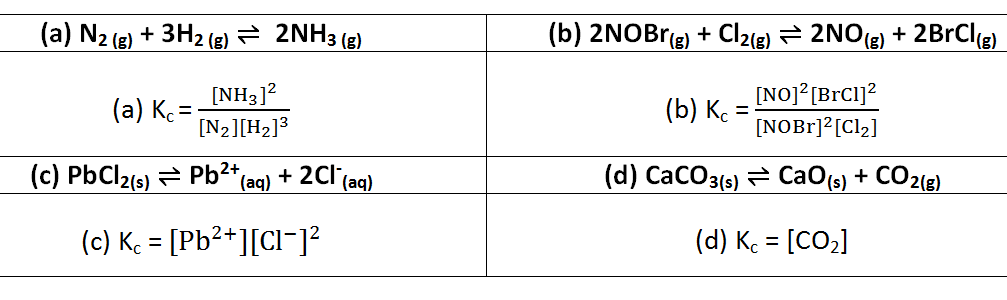
Resposta: alternativa: B
- A 1000 K o valor de Kp da reacção 2SO3 (g)⇌ 2SO2 (g) + O2 (g) é 0,338. Calcule o valor de Qp e diga em que direcção a reacção prosseguirá para o equilíbrio se inicialmente as pressões parciais forem: PSO3 = 0,2 atm; PSO2 = 0,4 atm; PO2 = 2,0 atm.
A Qp = 0,016 atm; direita (formação de produtos)
B Qp = 0,16 atm; direita
C Qp = 4,00 atm; esquerda (formação de reagentes)
D Qp = 8,00 atm; esquerda
E Qp = 4,00 atm; direita
RESOLUÇÃO
Qp é o quociente da reacção em função das pressões parciais e é idêntico a constante de equilíbrio em função das pressões parciais (Kp), a única diferença é que é calculado em função das pressões parciais em qualquer instante da reacção e não necessariamente a partir das pressões parciais no equilíbrio.
Assim:
Qp < Kp : significa que a razão entre as pressões parciais iniciais dos produtos e dos reagentes é muito pequena. Para se atingir o equilíbrio é necessário que os reagentes formem mais produtos, e neste caso o sistema evolui da esquerda para a direita.
Qp = Kp : significa que as pressões parciais iniciais são as pressões parciais no equilíbrio. Por isso o sistema está em equilíbrio.
Qp > Kp : significa que a razão entre as pressões parciais iniciais dos produtos e dos reagentes é muito maior. Para se atingir o equilíbrio é necessário que os produtos se regenerem em mais reagentes (formem mais reagentes), e neste caso o o sistema evolui da direita para a esquerda.
Vamos calcular:
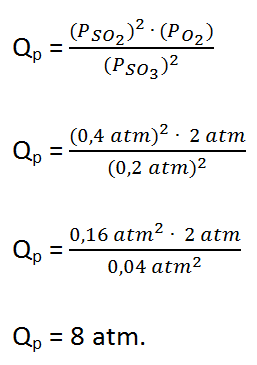
Portanto, Qp = 8 > Kp = 0,338, significa que a razão entre as pressões parciais dos produtos e dos reagentes é muito maior. Para se atingir o equilíbrio é necessário que os produtos se regenerem em mais reagentes (formem mais reagentes), e neste caso o eo sistema evolui da direita para a esquerda.
Resposta: alternativa: D
- 50. O Kcda reacção H2 (g)+ I2 (g) ⇌ 2HI (g) é 4. Quais serão as concentrações no equilíbrio das três espécies (H2, I2, HI), se as concentrações iniciais de H2 e I2 forem iguais a 1 mol/L e a de HI igual a zero?
A [H2] = [I2] = [HI] = 0,5 mol/L;
B [H2] = [I2] = 0,5 mol/L; [HI] = 0,25 mol/L
C [H2] = [I2] = 0,5 mol/L; [HI] = 1,0 mol/L
D [H2] = [I2] = 1,0 mol/L; [HI] = 0,25 mol/L
E [H2] = [I2] = 1,0 mol/L; [HI] = 0,5 mol/L
RESOLUÇÃO
No texto Cálculo da Constante deEquilíbrio a partir da tabela dissemos que exercícios desta natureza são facilmente resolvidos com ajuda de uma tabela:
H2 (g) + I2 (g) ⇌ 2HI (g)
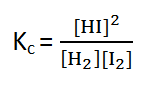
| Fases da reacção | [H2] | [I2] | [HI] |
| INÍCIO | 1 | 1 | 0 |
| REAGE/FORMA | - x | -x | +2x |
| EQUILÍBRIO | 1 - x | 1 - x | 2x |
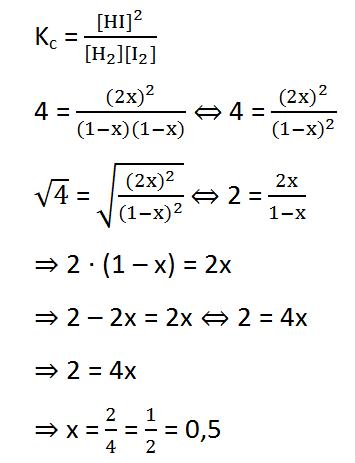
Assim, as concentrações no equilíbrio serão:
[H2] = [I2] = 1 – x
[H2] = [I2] = 1 – 0,5
[H2] = [I2] = 0,5 mol/L
[HI] = 2x
[HI] = 2 ∙ 0,5
[HI] = 1 mol/L
Resposta: alternativa: C

