Termoquímica: estuda as quantidades de calor envolvido (absorvido ou desprendida) em uma reacção química.
Calor (Q): é a energia que entra ou sai do sistema, em virtude da diferença de temperatura entre o sistema termodinâmico e as suas vizinhanças.
Entalpia: é uma propriedade extensiva de uma substância, que esta relacionada com o calor da reacção e permite calcular o calor absorvido ou desprendido numa reacção química.
Tipos de entalpia: de formação, decomposição, combustão, ligação e dissociação
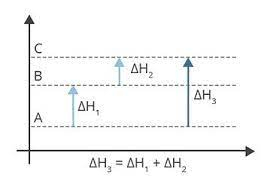
Lei de Hess: para uma dada reacção, a variação de entalpia é sempre a mesma, esteja essa reacção ocorrendo em uma ou em várias etapas.
Consequência de lei de Hess
DH = H1 – H2 se um processo apresentar “n” etapas, oDH total será: DH = H1 – H2…+ DHn
Entalpia de formação: é o calor liberado ou absorvido na formação de 1 mol de uma substância a partir de substâncias simples, no estado padrão, com H = 0.
Ex: Água líquida — H2O(l)
H2(g) + 1/2 O2(g) 1 H2O(l) ΔH = –286 kJ/mol
Ex: No processo de formação do H2SO4 líquido liberta-se 31,2 kcal. Tendo em conta os dados seguintes, calcule DHform (SO3)? DHform (H2O) = -68,3 kcal/mol;
DHform(H2SO4) = -193,9kcal/mol.
SO3 (g) + H2O (l) H2SO4 (aq) DH = -31,2 kcal
DH = DHH2SO4 – (DHSO3 + DHH2O)
32,2 kcal=193,9kcal-(DHso3 + (-68,3kcal)
DH = -94,4 kcal/mol
Entalpia de combustão é a energia liberada na combustão completa de 1 mol de uma substância no estado padrão.
Combustão completa do álcool etílico (C2H6O):
C2H6O(l) + 3 O2(g) 2 CO2(g) + 3 H2O(l) DHcomb = –1 368 kJ/mol
Entalpia de dissolução é aquela que o calor de dissolução é desenvolvido em 1 mol de substância numa quantidade de solvente, de tal que a adição de mais solvente não provoque um efeito térmico apreciável.
Ex: Dissolvendo álcool etílico em água pura, 1 mol de álcool em 4 mol de água teremos: C2H5OH + 4H2O SoluçãoDH = -898 cal
E dissolver-se 1mol de álcool etílico em 9mol de água teremos:
C5H5OH + 9H2O SoluçãoDH = -1678 cal
Entalpia de ligação (estado gasoso) é aquela que uma energia bem determinada resulta-se do movimento de vibração, rotação.
Ex: H2DH = +104,2 kcal/mol que é energia de ligação de H-H